Desde el descubrimiento del primer antibiótico en 1928 por Alexander Fleming, lo que sería la “penicilina”, trajo consigo un avance importante en la medicina, reduciendo los índices globales de mortalidad y el aumento en la esperanza de vida (Fig. 1). Sin embargo, en la actualidad, el uso indebido y excesivo de los antibióticos, ha originado una rápida resistencia de las bacterias a los antibióticos. La resistencia a los antibióticos es una de las estrategias por el cual las bacterias buscan evitar, expulsar, destruir o resistir concentraciones de un antibiótico que inhiban la proliferación bacteriana. Se ha descrito que un aumento en la resistencia bacteriana trae consigo la aparición de infecciones nosocomiales, aquellas que se originan en pacientes ingresados en un hospital o centros de atención hospitalarios1.
La Organización Mundial de Salud (OMS) ha clasificado a un grupo de bacterias con una alta resistencia a antibióticos comprometiendo los tratamientos convencionales. Este grupo de bacterias se ha denominado grupo ESKAPE cuyo nombre deriva del nombre científico de cada una de las bacterias (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter spp.), estas “superbacterias” representan una amenaza en las infecciones nosocomiales y comunitarias2.

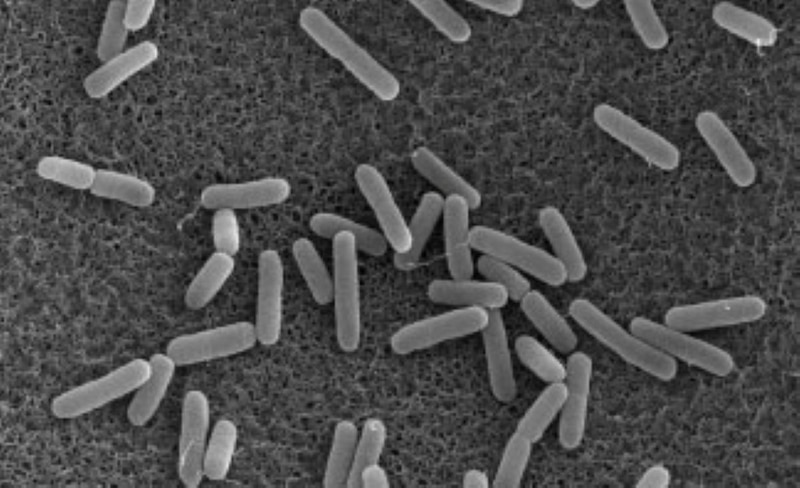
Pseudomonas aeruginosa es una bacteria Gram negativa cuya forma es bacilar con una flagelo que utiliza para su motilidad. La información genética contenida en el genoma de P. aeruginosa le ha permitido una gran plasticidad de sobrevivir en diferentes ambientes y adaptarse a condiciones complejas como estrés nutricional y resistir a una gran variedad de agentes antimicrobianos. P. aeruginosa produce una gran variedad de factores de virulencia como la secreción de enzimas que degradan proteínas, como proteasas, elastasas, metabolitos que inducen un estrés oxidativos como la piocianina, otros factores como ramnolípidos y la formación de biopelículas, matriz hecha de lípidos y proteínas, que funcionan como barrera física protectora frente a la absorción, transporte y acumulación de antibióticos hasta en un 25%. Esta diversidad de factores de virulencia producidos por P. aeruginosa está regulada por un proceso de comunicación bacteriana denominado como “quorum sensing” (QS), el cual es controlado por la producción de “moléculas señales” activando al unísono la producción de factores de virulencia de la bacteria3. En la figura 3, se muestra la producción de piocianina por P. aeruginosa, “pigmento de color azul-verde” un factor de virulencia, que genera estrés oxidativo en el huesped. Estudios han mostrado que cepas carentes de la producción de la molécula señal como P. aeruginosa DLasI necesaria para la comunicación entre las bacterias y modular el QS es incapaz de producir la pocianina.
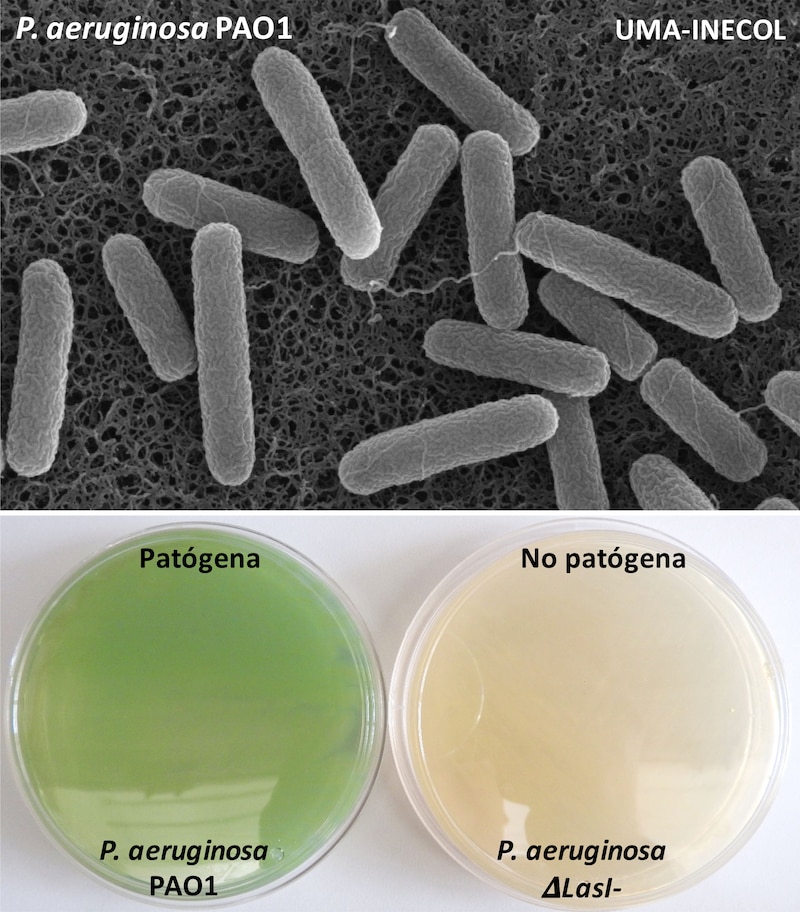
Recientemente, una de las alternativas en el control de la virulencia de P. aeruginosa es la búsqueda de moléculas que inhiban la producción de factores de virulencia de la bacteria sin generar una resistencia bacteriana afectando el QS de estas. Este mecanismo de inhibir el QS de la bacteria ha sido descrito como “quorum quenching” o inhibición del quorum de tal manera que las moléculas bloquean o inactivan la molécula señal propia de la bacteria afectando la virulencia de la bacteria. Diversos estudios han mostrado que la obtención de moléculas a partir de extractos vegetales y/o microorganismos, la síntesis o el reposicionamiento de moléculas similares a las “moléculas señal” del QS representan una alternativa prometedora en el control de la virulencia de la bacteria sin dar origen a resistencia como los antibióticos convencionales (Fig. 3).

La identificación de nuevas moléculas como blancos moleculares en la regulación de genes de virulencia aunados a los tratamientos convencionales en el control de las “bacterias ESKAPE” o “superbacterias” permitirá el desarrollo de estrategias de control de infecciones nosocomiales o comunitarias emergentes.
Referencias
1Bush LM, Vazquez-Pertejo MT (2024). Infecciones por Pseudomonas y patógenos relacionados. https://www.msdmanuals.com/es/professional/enfermedades-infecciosas/bacilos-gramnegativos/infecciones-por-pseudomonas-y-pat%C3%B3genos-relacionados.
2Mulani MS, Kamble EE, Kumkar SN, et al., (2019) Emerging strategies to combat ESKAPE pathogens in the Era of antimicrobial resistance: A review. Front. Microbiol. 10:539
3Singh S, Singh SK, Chowdhury I, Singh R. Understanding the Mechanism of Bacterial Biofilms Resistance to Antimicrobial Agents. Open Microbiol J. 2017; 11(1):53-62
1Laboratorio de Microbiología Ambiental, 2Laboratorio de Farmacología Molecular, 3Unidad de Microscopía Avanzada, Red de Estudios Moleculares Avanzados del INECOL.