Para la atención psiquiátrica, se autorizan más de 600 mil cajas de medicamentos controlados
Ansiolíticos y antidepresivos comenzarán a comercializarse a nivel nacional en atención a pacientes que se encuentran en tratamiento psiquiátrico
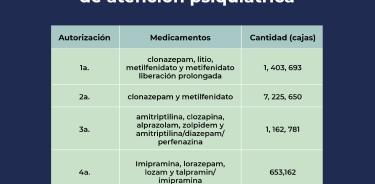
Cofepris autorizó la cuarta liberación de medicamentos de atención psiquiátrica, con lo que son ya más de 10 millones de cajas de fármacos que estarán disponibles en el país
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), informó que se otorgó la autorización para que 653,162 cajas de medicamentos para tratamientos psquiátricos puedan ser vendidas en el país.
Dicha liberación es para las medicinas bajo los nombres de: imipramina, lorazepam, lozam y talpramin/Imipramina, que ya podrán comenzar a ser distribuidas para su venta en todo el país.
Todos estos medicamentos, forman parte de 43 lotes producidos por Psicofarma, los cuales fueron aprobados después de un riguroso análisis técnico.
La Cofepris puntualizó que, con esta cuarta liberación de medicamentos para su comercialización, suman ya 10 millones 445,286 cajas de medicamentos de atención psiquiátrica que estarán disponibles en todo el territorio nacional, para los pacientes que los necesiten, al tiempo que puntualizó dicha comisión, que la comercialización de los fármacos es totalmente responsabilidad de la empresa.
Recordó además, que se mantiene acciones de regulación proactiva, a fin de lograr establecer una ruta regulatoria que promueva avances en el acceso a medicamentos de atención psiquiátrica, brindando acompañamiento de manera transparente a la empresa para que presente la documentación y las pruebas requeridas, atendiendo las claves de alta prioridad para suministro a los sectores público y privado.
Para ello, es a través de los dictaminadores de dicha agencia regulatoria del país, que se da seguimiento puntual a los avances del fabricante en el cumplimiento de acciones para corregir las irregularidades detectadas, y puntualizadas en la Carta de Hallazgos, del pasado 22 de febrero del año en curso, eventualmente, reanudar la producción de más medicamentos controlados.



