No cualquier espermatozoide es apto para fecundar, no cualquiera se mueve o nada lo suficiente ni de la forma adecuada. No cualquier esperma está lo suficientemente “capacitada” para la empresa de la vida.
Evaluar estas características no es fácil ni tampoco fiable, puesto que depende de un “ojo de buen cubero” humano y su interpretación de datos. No obstante, en la Facultad de Estudios Superiores (FES) Iztacala de la UNAM, el grupo de investigación de Andrés Aragón Martínez avanza a la vanguardia en este campo y se encuentra cerca de resultados que podrán mejorar los métodos de concepción mediante técnicas de reproducción asistida en humanos y animales no humanos. Para ello, han desarrollado técnicas novedosas y ahora emplean el uso de tecnología como inteligencia artificial y “machine learning” para interpretar grandes cantidades de información.
En entrevista para Ciencia UNAM, comparte los detalles de su investigación y la explicación de cómo los espermatozoides por sí mismos no son suficientes para la fecundación y necesitan “capacitación”, acción que también se puede hacer “in vitro”.
ESPERMA EN FORMA.
Comúnmente y a través de muestras que se analizan en el microscopio, se evalúa la eficiencia de los espermatozoides analizando su cantidad y forma, si se mueven y están vivas. “Este es el primer paso para saber si un animal tiene la potencialidad de fertilizar y sus células lleguen hasta donde se encuentra el ovulo en el tracto reproductor femenino, tanto en humanos como en animales de fertilización interna de importancia alimentaria, como los porcinos, bovinos y caprinos”.
No obstante, explica, muchos grupos de investigación alrededor del mundo estudian los procesos para hallar un aspecto celular o molecular, o cualquier parámetro que muestre su efectividad para fertilizar. Actualmente, añade, no hay indicador que otorgue esa certeza.
El análisis primario para dar una idea de la viabilidad y efectividad del semen es la espermatobioscopia, cuya información más relevante gira en torno a su movilidad. Hay parámetros de la Organización Mundial de la Salud (OMS) que sugieren los valores que el sujeto debe de alcanzar en su espermatobioscopia para considerarlo en un parámetro normal: entre el 55 y 60 por ciento de células móviles. “Pero eso no garantiza que lleguen a fertilización, la cuestión es de qué manera se mueven”, dice el investigador.
De los varios cientos de millones que se inseminan naturalmente, sólo entre 30 y 60 llegan al sitio de fertilización, añade, es en estas células “capacitadas”, que los investigadores coordinados por Aragón se han enfocado, para estudiar qué las hace especiales y diferentes de las millones eyaculadas que se quedaron fuera de la competencia.
Parte de su investigación consiste en un desarrollo computacional para evaluar mejor la calidad espermática más allá de los procesos convencionales, que cuentan manualmente a través del microscopio. De nuevo, lo importante no sólo es la cantidad, sino cómo se mueven.

NADO ESPERMÁTICO.
Para evitar sesgos al observar el microscopio, algunos grupos en clínicas utilizan los sistemas de análisis asistidos por computadora (CASA por sus siglas en ingles: Computer-Aimed Sperm Analysis), arreglos de microscopios acoplados a una cámara y a una computadora, con software específico para analizar a los espermatozoides, apunta el especialista y responsable del Laboratorio de Gametos y Desarrollo Tecnológico de la FES Iztacala.
Pero estas células masculinas son muy veloces respecto a su tamaño, pueden moverse a través de 25 micras por segundo y el ojo humano no puede seguirlas con precisión. Sin embargo, si son grabadas a tiempos definidos se puede saber su velocidad y definir más parámetros cinemáticos a través de un CASA, del cual los universitarios han desarrollado su propio sistema.
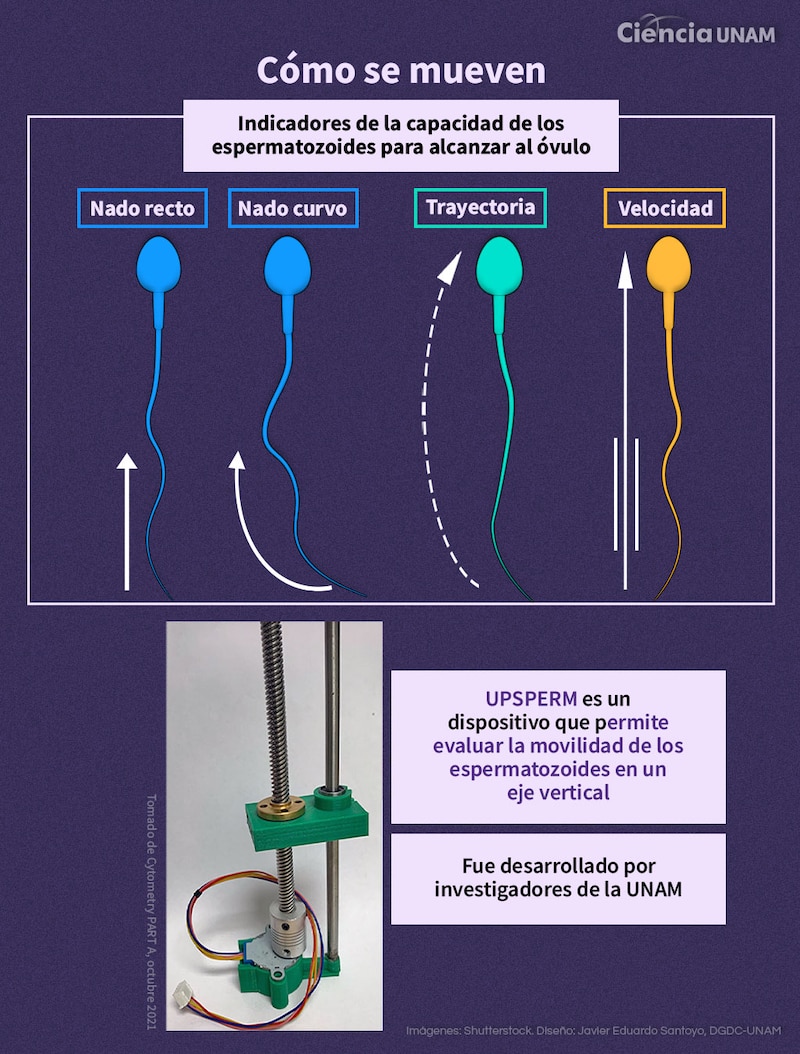
Por ejemplo, uno en el que han puesto énfasis los universitarios es su nado, del que hay dos estilos: lineal y curvo. “Consideramos, con base en esos estudios, que la forma de nado es un indicador de la capacidad de los espermatozoides para alcanzar al ovocito, no sólo cuántas nadan, si no cómo lo hacen, curva o recta. A eso se le llama heterogeneidad del nado celular y analizar esto es un reto por sí mismo cuando tenemos millones de datos por delante”.
Otro en el que han trabajado es la trayectoria que siguen las células, coordenadas a partir de las cuales se obtienen medidas condensadas que son los parámetros de movilidad, explica.
Sin embargo, el problema generado por esta solución es que proporciona grandes bases de datos, lo cual complica el análisis, acota el investigador.
Generar esta nueva información sobre la movilidad espermática generó bases de datos gigantescas, enfatiza Andrés Aragón, puesto que una imagen ya no es un dato, sino pixeles de miles de espermatozoides. Para su análisis, han empleado herramientas de aprendizaje automático, “machine learning” e inteligencia artificial. “Con estadística clásica o visual no podemos identificar la estructura de la heterogeneidad. Necesitamos que lo vea una máquina”.
ESPERMA CAPACITADA.
En cuestiones de fertilidad humana, los espermatozoides tienen que pasar por un proceso llamado “capacitación”. La célula recién eyaculada no puede fertilizar y tiene que pasar por una serie de procesos fisiológicos que ocurren en el tracto reproductor femenino, explica el investigador de la FES Acatlán.
En el caso de técnicas de fertilización asistida, los espermatozoides obtienen y se capacitan en una sustancia con temperatura “in vitro”. Investigaciones a lo largo de los años revelan que no se capacita el 100 por ciento, sino el 25 o 30, dice el académico, quien apunta que sus métodos también capacitan y buscan identificar este tipo de células.
“No hay nada en el mundo que nos indiquen cuando un espermatozoide está capacitado, los investigadores alrededor del mundo lo hacen de manera visual o aplicando filtros a sus bases de datos, de acuerdo a ciertos parámetros de movilidad. Pero no hay nada objetivo que lo indique, es a juicio del investigador”. Las técnicas diseñadas en su laboratorio van en buen camino para develar la capacitación vista a través de sus patrones de nado.
Ese cambio enorme se llama “hiperactivación” y sólo así los espermatozoides pueden fertilizar entre todos los millones de células eyaculadas, explica. “No hay manera de identificarlos, pero con lo que desarrollamos y nuestra colaboración con otros expertos estamos en ese camino. Esto permitirá mejorar prácticas de inseminación artificial y fertilización ‘in vitro’”.
AVANCES TECNOLÓGICOS.
El conjunto de técnicas y de nueva tecnología, acota, han permitido diseñar modelos para identificar patrones de movimiento inducidos por comunicación serotoninérgica, ejemplifica. La serotonina es un neurotransmisor que inicialmente se describe en el sistema nervioso central y juega un papel central en el comportamiento humano, el apetito y en la afectividad, añade. “Se ha encontrado serotonina en el tracto reproductor femenino, la pregunta básica es: ¿la serotonina modifica los patrones de nado de los espermatozoides? Hemos encontrado que sí, entonces es información relevante en el caso de humanos y otros animales de interés”.
Otro avance del grupo de Aragón es UPSPERM, un dispositivo que permite evaluar la movilidad de los espermatozoides en un eje vertical, parámetro importante en la fertilidad humana, puesto que el órgano reproductor femenino no es horizontal, sino vertical. Este sistema ya ha sido patentado.
El científico concluye enfatizando que estos avances serían muy difíciles de lograr sin el uso de nuevas tecnologías como la inteligencia artificial, así como de software abierto, cuya democratización permite que todos tengan acceso. “Son grandes herramientas, pero sólo son eso. Falta que las usemos de manera creativa en la resolución de problemas en la investigación. Eso es muy factible”.
*Colaboración de la Dirección General de Divulgación de la Ciencia de la UNAM